Archive for Desember 2013
BAHAN WAJIB DIPELAJARI; KLS 11 IPA / SMT 2 / SMA XAVERIUS 1 JAMBI
sebagai salah satu Bahan ujian akhir
semester Genap / enrichment program
sebagai salah satu Bahan ujian akhir
semester Genap / enrichment program
MENGENAL
MEKANISME REAKSI ORGANIK
oleh
Elizabeth T,S.Si, M.Pd
Sebelum
mempelajari reaksi kimia dalam senyawa organik mari kita mengenal beberapa
istilah yang akan digunakan serta faktor-faktor apa saja yang akan memengaruhi
reaksi kimianya.
1. Pemecahan ikatan kovalen
Senyawa
karbon dapat mengalami pemecahan ikatan kovalen dengan membentuk zat
antara/intermediate.atau keadaan transisi melalui 2 cara yaitu:
a. Pemecahan homolitik (simetris) --> menghasilkan radikal bebas
b. Pemecahan heterolitik (tidak simetris) --> menghasilkan 2 spesi ion yaitu
karbokation dan karboanion
2. Jenis zat antara
Ada 2 jenis
zat antara/intemediate yang sangat reaktif yaitu:
a. Radikal --> spesi atom yang mengandung 1
elektron yang belum berpasangan.
Urutan
kestabilan radikal:
Tersier>
sekunder > primer > metil
b. Ion karbokation/karbonium --> spesi atom C yang kekurangan 1
elektron pada kulit terluarnya à bermuatan positif.
Urutan
kestabilan radikal:
Tersier>
sekunder > primer > metil
c. Ion karboanion/karbanion --> spesi atom C yang kelebihan 1
elektron pada kulit terluarnya à bermuatan listrik negatif.
Urutan
kestabilan radikal:
Tersier<
sekunder < primer < metil
3. Pereaksi Elektrofilik dan Nukleofilik.
a. Pereaksi elektrofilik --> filia=cinta --> cinta elektron berarti spesi ini
bermuatan positif sehingga akan menyerang daerah bahkan inti atom yang kaya
elektron/bermuatan negatif.
Contoh: BF3, SO3, AlCl3,
SbF3, CO2, HSO3 +, NO2 +,
Br +.
b. Pereaksi nukleofilik --> filia=cinta --> cinta nukleus berarti spesi ini
bermuatan negatif sehingga akan menyerang daerah bahkan inti atom yang miskin
elektron/bermuatan positif
Contoh: X -, H2O, OH -,
NH3, NH2 -, CN -, ROH, RO –
Catatan: spesi bermuatan jauh lebih reaktif ketimbang
spesi netral (tak bermuatan).
FAKTOR YANG
MEMENGARUHI KEBERADAAN ELEKTRON PADA IKATAN
Adanya
kerapatan elektron memicu dimulainya suatu reaksi kimia !
Hal-hal apa saja
yang menyebabkan keberadaan elektron pada ikatan?
1. Elektronegativitas -->dengan skala Linus Pauling (4 (F);
3,5 (O), 3 (N dan Cl), 2,8 (Br) menyatakan bahwa kemampuan suatu atom suatu
unsur untuk menarik elektron ke arah dirinya sendiri.
2. Efek induksi --> pengaruh gugus atom yang lebih
elektronegatif sepanjang rantai C
terhadap perpindahan pasangan elektron ke arah atom yang bersifat
elektronegatif. Atom/gugus yang mempunyai afinitas elektron lebih besar
daripada hidrogen dikatakan bahwa atom/gugus tsb mempunyai efek induktif
negatif. Sedangkan yang cenderung
melepaskan elektron disebut efek induktif positif.
Efek induksi dijumpai pada rantai karbon berikatan sigma. Perhatikan pada senyawa berikut:
C - C - C - C - Cl
4 3 2 1
Atom klor yang bersifat sangat elektronegatif akan menginduksi atom C no 1 sehingga atom C no 1 menjadi lebih ber"elektron". Dengan demikian atom C no 1 mampu menginduksi atom C no 2 sehingga atom C no 2 mempunyai kerapatan elektron lebih. Dst. Namun semakin jauh dari atom Cl, pengaruh induksi semakin lemah.
Efek induksi dijumpai pada rantai karbon berikatan sigma. Perhatikan pada senyawa berikut:
C - C - C - C - Cl
4 3 2 1
Atom klor yang bersifat sangat elektronegatif akan menginduksi atom C no 1 sehingga atom C no 1 menjadi lebih ber"elektron". Dengan demikian atom C no 1 mampu menginduksi atom C no 2 sehingga atom C no 2 mempunyai kerapatan elektron lebih. Dst. Namun semakin jauh dari atom Cl, pengaruh induksi semakin lemah.
3. Efek mesomerik --> perpindahan sementara phi elektron
atau pasangan elektron bebas ke salah satu atom yang terikat dengan ikatan
rangkap sebagai kebutuhan pereaksi yang bereaksi. Ada mesomeri positif ada mesomeri negatif. Efek ini dijumpai pada ikatan phi.
4. Efek resonansi --> perpindahan/pergerakan elektron
valensi di dalam suatu molekul tanpa mengubah struktur molekulnya.
Makin banyak bentuk resonansi suatu molekul maka molekul
tsb makin stabil. Mengapa?
5. Hiperkonjugasi --> peristiwa perpindahan/delokalisasi
elektron
6. Efek Sterik
7. Pengaruh pelarut
8. Sifat asam-basa Nukleofil/elektrofil nya
9. Gugus perginya
TIPE REAKSI ORGANIK
Reaksi
alkana (hidrokarbon jenuh): cenderung tidak reaktif (lembam). Mendobrak kelembaman senyawa alkana sehingga
menjadi reaktif hanya jika salah satu atom H diganti dengan gugus:
a. Halogen (X=Cl. Br, I)
b. Gugus –OH
(alkohol)
c. Gugus –NH2
d. Gugus R - C≡N
e. Gugus karbonil aldehida dan keton: R- CO – R
f. Reaksi hidrokarbon tak jenuh yaitu alkena
(rangkap dua) dan alkuna (rangkap tiga), reaksi menjadi reaktif karena adanya
elektron phi pada ikatan rangkapnya.
Secara umum
terdapat 4 tipe reaksi kimia organik:
1. Reaksi
substitusi/penggantian
=suatu atom/gugus di dalam suatu senyawa diganti oleh suatu
atom/gugus lain dari senyawa yang lain.
Konsep dasarnya adalah atom/gugus yang mengganti haruslah lebih
reaktif ketimbang atom/gugus yang diganti.
Contoh:
a. Reaksi radikal bebas alkana + uv/X2 -->
Alkil halida + HX
(X = atom
halogen yaitu Cl, Br, I).
b. Alkana + HX -->
R-X + H2
(R-X adalah
senyawa alkil halida)
Ada 2 jenis reaksi substitusi yaitu:
1.
Substitusi Nukleofilik (SN) 1
2.
Substitusi Nukleofilik (SN) 2
Subtitusi
Nukleofilik (SN 1)
SN 1 ditandai dengan reaksi yang melalui jalur
karbokation. Oleh karena itu, “gugus
pergi “ (leaving group) haruslah terikat pada karbo tersier atau sekunder untuk
menstabilkan zat intermediate nya.
Dampak lain pada reaksi SN 1 memungkinkan terjadinya pergeseran hidrida
dan metida.
NOTE:
Kekuatan Basa: Kuat-lemahnya basa tidak penting karena
basa tidak terlibat dalam tahap penentu laju reaksi alias tidak memengaruhi
pembentukan karbokation.
Gugus pergi (Leaving groups): gugus pergi yang baik diperlukan
seperti halida (-X) atau tosilat karena “gugus pergi” jelas terlibat dalam
tahap pembentukan karbokation
Hati-hati terhadap reaksi penataan ulang (baik geseran
hidrida maupun metida) pada jalur SN1 karena ingat di sini terjadi pembentukan
karbokation sebagai zat intermediatnya.
Cermati mekanisme jalur SN1 secara umum sbb:
Substitusi Nukleofilik SN
2:
Cermati bentuk umum mekanisme SN2:
nuc: = nucleophile
X = leaving
group (usually halide or tosylate)
Pada reaksi
SN2, “gugus pergi” (gugus umum yang biasa adalah halida atau tosilat) diganti
dengan suatu nukelofil. Reaksi ini
bekerja paling baik pada metil dan halida primer karena alkil halida yang
mengandung banyak cabang dapat menghalangi serangan Nukelofil dari
belakang. Pada halida sekunder dan
tersier reaksi SN2 sulit terjadi.
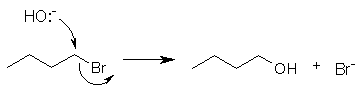
Perhatikan contoh ion hidroksida sebagai Nukleofil dan Bromine sebagai “gugus pergi” yang baik:
NOTE:
-SN2 cenderung untuk mengalami inversi
konfigurasi disebabkan serangan Nukleofil dari arah belakang.
Pelarut protik
seperti air dan alkohol menstabilkan Nukleofil yang tidak bereaksi
sekalipun. Oleh karena itu pelarut polar
yang aprotik misalnya eter, keton, hidrokarbon
tersubstitusi halogen juga diperlukan.
Nukleofil yang baik
diperlukan karena keadaan ini terlibat dalam tahap penentu laju reaksi.
Gugus pergi yang baik seperti halida atau tosilat diperlukan pada tahap penentu laju
reaksi.
2. Reaksi adisi
=Reaksi yang
mengubah ikatan tak jenuh atau phi (rangkap) menjadi ikatan jenuh atau sigma
(tunggal).
Reaktivitas : HI > HBr > HCl >> HF (asam lebih kuat = elektrofil baik )
Reaktivitas : HI > HBr > HCl >> HF (asam lebih kuat = elektrofil baik )
Pada mekanisme adisi elektrofil, elektron phi lah
yang memulai serangan terhadap elektrofil membentuk karbokation yang
stabil. Selanjutnya Nukleofil menyerang
karbokation untuk membentuk produk.
Karena serangan
awal dilakukan oleh elektron phi terhadap sebuah elektrofil, maka adisi HX pada alkena
disebut reaksi adisi elektrofilik (menyukai elektron).
Beberapa
jenis adisi elektrofil sbb:
- Hydroxylation
- Oxidative Cleavage
- Epoxidation
- Cyclopropanation
- Halohydrin Formation
Contoh:
a. Hidrogenasi/reduksi:
Adisi H2/Ni/Pt/Pd/ Ru + alkena --> alkana
Adisi H2/Ni/Pt/Pd/ Ru + alkena --> alkana
b. Hidrogenasi/reduksi:
Adisi H2/Ni / Pt / Pd/ Ru + aldehida --> alkanol / alkohol
Adisi H2/Ni / Pt / Pd/ Ru + aldehida --> alkanol / alkohol
c. Hidrogenasi/reduksi:
Adisi H2/Ni/Pt/ Pd/Ru + benzena --> sikloheksana
Adisi H2/Ni/Pt/ Pd/Ru + benzena --> sikloheksana
d. Adisi H2O + alkena --> alkanol / alkohol
e. Adisi HX + alkena --> alkil halida
(berlaku aturan Markovnikov untuk alkena
tak simetris.
Ingat: Kimia Kls X Smt 2).
Ingat: Kimia Kls X Smt 2).
Think Time:
Pikirkan mekanisme reduksi sikloheksena + H2/Pt --> ???
HIDROBORASI
Hidroborasi merupakan salah satu aplikasi adisi
elektrofilik. Hidroborasi bisa
dijelaskan mengikuti aturan Markovnikov maupun anti Markovnikov. Produk anti diperoleh jika pada
hidroborasi ditambahkan senyawa peroksida (H2O2).
Lihat contoh hidroborasi pada alkena tak simetris
berikut, yang mengikuti aturan Markovnikov:
Sedangkan mekanisme reaksi
hidroborasi yang mengikuti reaksi AntiMarkovnikov dapat dijelaskan pada gambar
sbb:
Pada tahap awal, elektron
phi menyerang atom H membentuk cincin segi 4 sebagai ikatan rangkap intermediat. Keadaan ini disebabkan senyawa intermediat
yang terbentuk ini akan membentuk produk AntiMArkovnikov. Atom boron bersifat sangat elektrofilik
karena terdapat orbital p yang masih kosong.
Orbital seperti ini sangat mengingini elektron sehingga membentuk
sedikit interaksi ikatan dengan ikatan phi.
Oleh karena beberapa kerapatan elektron yang berasal dari ikatan rangkap bergerak
menuju ikatan dengan Boron, atom karbon berseberangan dengan Boron dalam keadaan
sedikit kekurangan elektron atau sedikit muatan positif. Muatan positif bisa menjadi paling stabil
melalui pembentukan karbon tersubstitusi sehingga karbon yang berseberangan dengan
Boron cenderung menjadi karbon yang paling tersubstitusi (karbon tersier atau
sekunder). Namun pada kasus reaksi ini, segera
sesudah senyawa intemediat diputuskan, BH2 akan menempel pada karbon yang
paling TIDAK tersubstitusi.
CATATAN:
Jika digunakan pereaksi H2O2 maka:
Peroxide akan mengusir boran
(BH2) dan menggantinya
dengan alkohol untuk membentuk produk anti Markovnikov.
Contoh lain adisi Anti Markovnikov:
Jika pereaksi yang
digunakan adalah senyawa peroksida pada reaksi adisi maka produk yang melimpah
adalah produk anti Markovnikov. Lihat
perbandingan reaksi adisi Hbr pada 1 propena dalam adisi Markovnikov dan non
Markovnikov sebagai berikut:
ADISI NUKLEOFILIK TERHADAP GUGUS KARBONIL
Apakah gugus karbonil? Gugus karbonil adalah C=O
perhatikan bahwa atom Oksigen menjadikan ikatan C=O menjadi reaktif. Mengapa???
Contoh reaksi
adisi nukleofilik terhadap gugus karbonil:
Perhatikan, pada reaksi tsb, ion asetilida
(dari kel.alkuna) berperan sebagai nukleofil.
Bentuk mekanisme umum
adisi nukleofilik terhadap gugus karbonil sbb:
Tahap awal adalah serangan
Nukleofil terhadap karbon bermuatan positif parsial (yang berasal dari gugus karbonil
(C=O). Selanjutnya terbentuk senyawa intermediate
dengan muatan atom oksigen yang bermuatan full negatif. Atom oksigen akan terprotonasi untuk menghasilkan
alkohol.
Reaksi adisi lainnya misalnya:
f. Adisi HCN + keton --> H O - R – CN
Catatan:
Alkohol=alkanol:
R –OH (ada gugus reaktif –OH)
Aldehida: R – HC=O
(ada gugus reaktif – C=O yang disebut gugus karbonil)
Keton =
alkanon: R – RC = O (ada gugus reaktif –
C=O yang disebut gugus karbonil)
Reaksi identifikasi adanya ikatan rangkap pada alkena dikenal sebagai reaksi brominasi alkena:
g. Adisi alkena
+ X2/ CCl4 atau CH2Cl2 --> dihalida alkana
Hint: CCl4 atau Ch2Cl2 adalah pelarut nonpolar.
Reaksi identifikasi adanya ikatan rangkap pada alkena dikenal sebagai reaksi brominasi alkena:
Adisi Br2 + alkena --> bromo alkana
(Adanya senyawa berikatan rangkap ditandai dengan
hilangnya warna merah kecoklatan dari air Brom (Br2) karena Br2 teradisi oleh
ikatan rangkap pada alkena).
Buatlah mekanisme reaksi adisi sbb:
Sikloheksena + Br2/ CCl4 --> siklo 1.2 dibromo heksana
3.
Reaksi Eliminasi
=Reaksi
kebalikan dari reaksi adisi. Reaksi yang mengubah ikatan sigma menjadi ikatan
phi.
=berlaku
eliminasi beta.
Contoh:
a. R-OH + H2SO4/110o C --> alkena + H2O
Ingat bahwa
alkena merupakan produk utama sedangkan H2O adalah produk samping.
Seringkali
dalam reaksi kimia organik, produk samping tidak ditulis. Kendati demikian agar anda dapat membuat
reaksi kimia menjadi setara koefisien reaksi maka semua produk samping yang
dihasilkan perlu ditulis.
b. R- X + NaOH/etanol -->
alkena + Na-X + H2O
Berlaku
untuk hal yang sama pada reaksi sebelumnya bahwa, Na-X dan H2O adalah produk
samping. Sedangkan Alkena merupakan produk mayor sekaligus produk utamanya.

Reaksi eliminasi juga terdiri dari dua tahap:
1.
Eliminasi 1
2. Eliminasi
2
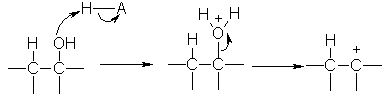
Eliminasi 1:
Mekanisme E1 secara
umum:
B: = basa
X = gugus pergi (umumnya halida atau tosilat)
X = gugus pergi (umumnya halida atau tosilat)
Pada mekanisme
E1, tahap pertama adalah hilangnya gugus pergi yang berjalan pada tahap lambat
sebagai penentu laju reaksi. Hasil dari
keadaan ini yaitu terbentuklah karbokation.
Selanjutnya hidrogen tetangga akan diserang oleh basa sehingga elektron
dari hidrogen-karbon akhirnya membentuk double bond. Keterlibatan pembentukan karbokation
memungkinkan terjaidnya reaksi penataan ulang.
Contoh reaksi E1:
Gugus pergi diperlukan seperti halida atau tosilat
karena terlibat pada tahap penentu laju reaksi
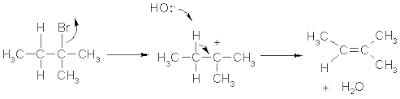
Contoh lain E1: Dehidrasi alkohol
Mekanisme umum dehidrasi alkohol
sbb:
Tahap awal adalah melibatkan protonasi
alkohol oleh suatu asam diikuti hilangnya molekul air sehingga dihasilkan karbokation
(jalur E1):
Eliminasi terjadi ketika asam konjugasi
dari suatu basa menyerang atom Hidrogen. Produk akhir dihasilkan alkena.
Contoh reaksi dehidrasi alkohol:
(jelaskan mekanismenya)
Pada mekanisme
reaksi E2, basa menyerang proton (atom H) yang menjadi tetangga “gugus
pergi”nya lalu mendorong elektron membentuk ikatan rangkap (Double bond)
sehingga mengusir gugus pergi. Ketika
reaksi basa yang menyerang proton terjadi bersamaan dengan diusirnya gugus
pergi maka reaksi ini disebut dengan reaksi E2 atau eliminasi beta (concerted
reaction).
Contoh reaksi
E2:

Basa kuat: Basa kuat
diperlukan karena basa terlibat pada tahap penentu laju reaksi
Gugus pergi: Gugus pergi
yang baik diperlukan seperti halida atau tosilat karena juga terlibat pada
tahap penentu laju reaksi.
Stereokimia: Seringkali terjadi stereokimia
antiperiplanar
NOTE:
Tulis berbagai basa kuat yang efektif digunakan dalam reaksi E2. Bagaimana dengan Na-etoksida dalam etanol ? atau kalium tersbutoksida.
Buatlah mekanisme E2 1 bromodekana + K-tersbutoksida
ATURAN ZAITSEV pada eliminasi BETA:
JIka produk alkena yang diperoleh MELIMPAH (DOMINAN) adalah alkena yang paling tersubstitusi pada mekanisme E2 ini maka disebut ekiminasi ZAITSEV.
Coba kerjakan pada 2 bromo 2 metil butana + CH3-Ch2-O-Na/etanol --> ...... + ........... (produk apa yang lebih melimpah???)
4. Reaksi Penataan Ulang / Rearrangement)
=reaksi yang
berlangsung degan penataan ulang atom-atom di dalam suatu molekul untuk
mencapai bentuk/struktur yang lebih stabil.
Ingat:
kestabilan di sini diartikan apa terkait kinetika reaksi maupun termodinamika
yang telah Anda pelajari pada semester 1.
Contoh:
C - C - C= C + HCl --> C - C- C+ - C --> C - C+ - C - C
l l l
C C C
(karbokation sekunder) (karbokation tersier=stabil)
= tidak stabil
l l
Cl
l
C - C - C - C C - C - C - C l l l
C Cl C
(produk kurang stabil/minor) (produk stabil/mayor)
(produk kurang stabil/minor) (produk stabil/mayor)
TUGAS 1. (WAJIB DIKERJAKAN !!! )
Soal 1.
Jelaskan
mengapa 1.3 pentadiena lebih stabil ketimbang 1.4 pentadiena
Soal 2.
Mengapa ion karbonium
C-C+ – C lebih stabil ketimbang C – C – C+ ?
Soal 3.
Urutkan atas
dasar kenaikan kebasaan dan nukleofilitas anion-anion sbb:
a. Cl-
; Br - ; F - ; I -
b. CH3-O -
; OH - ; CH3CO2 -
Soal 4.
Diketahui kecepatan
suatu reaksi organik sbb:
(CH3)3 C – Cl
+ OH - --> (CH3)3 COH + Cl -
a. Tentukan persamaan kinetika reaksi kimia bila orde
nol terhadap OH -
b. Tulis mekanisme reaksi organik tsb
Soal 5
Hitung perubahan
energi bebas (∆Go pada 25oC)
untuk isomerisasi isobutana menjadi n-butana bila diketahui ∆H isobutana dan
n butana berturut-turut
adalah -31,5 dan -29,8 kkal/mol. Adapun entropinya (∆So) berturut-turut adalah 70,4 dan 74,1 kkal/mol/oC.
Soal 6 (lihat gambar sbb)
SOAL 7 . (lihat gambar sbb)
Tentukan klasifikasi spesi sbb apakah nukleofil
atau basa elektrofil:
a. CH ≡ C -
b. SO3
c. RCOCl
d. RSH
e. R2S
f. H2O
g. HCHO
SOAL 8 (lihat gambar sbb)
SOAL 9 (lihat gambar sbb)
Tulis mekanisme reaksi antara ozon (O3) dengan:
a. CH3 - CH = CH - CH3
b. Siklobutana
c. (CH3)2C = CH - CH2
TUGAS 2
THINK TIME:
TINJAUAN KESTABILAN:
Stabil yang manakah? Stabil kinetika atau stabil
termodinamika. Coba Anda pikirkan.